Dalam kehidupan sehari-hari, elektrolisis biasa digunakan untuk penyepuhan logam supaya tidak mudah berkarat. Misalnya penyepuhan perak pada peralatan rumah tangga.
Dalam proses penyepuhannya, logam yang akan disepuh dijadikan katoda yang akan mengalami reduksi, sedangkan logam penyepuhnya dijadikan anoda yang akan mengalami oksidasi, dan sebagai larutan eletrolitnya digunakan larutan yang mengandung komponen ion logam penyepuh.
Untuk lebih jelasnya, mari kita bahas pada materi berikut.
Pengertian Elektrolisis
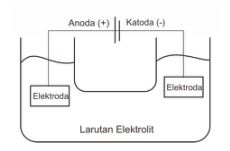
Elektrolisis adalah proses penguraian suatu elektrolit dengan arus listrik, dimana energi listrik (arus listrik) tersebut akan diubah menjadi energi kimia (reaksi oksidasi-reduksi) melalui elektroda-elektrodanya.
Elektroda yang menerima elektron dari sumber arus listrik adalah katoda yang akan mengalami reaksi reduksi dimana elektrodanya bermuatan negatif (-), sedangkan elektroda yang mengalirkan elektron kembali ke sumber arus adalah anoda yang akan mengalami reaksi oksidasi dimana elektrodanya bermuatan positif (+).
Sel Elektrolisis
Dalam sel elektrolisis, terdapat ciri-ciri utama, yaitu :
- Terdapat larutan elektrolit yang mengandung ion bebas, dimana salah satu komponen ionnya terkandung ion dari anoda. Ion-ion tersebut nantinya akan memberi atau menerima elektron yang akan mengalir melalui larutan elektrolit.
- Terdapat sumber arus listrik dari luar untuk selanjutnya akan diubah menjadi energi kimia.
- Terdapat dua elektroda, dimana katoda (-) akan mengalami reduksi sedangkan anoda (+) akan mengalami oksidasi.
Perlu diperhatikan reaksi yang terjadi pada katoda maupun anoda. Berikut ini merupakan aturan reaksinya.
Pada katoda-reduksi :
1. Ion positif dari larutan elektrolit akan tereduksi, kecuali ion dari larutan golongan I A, II A, Al, dan Mn, yang tereduksi adalah air.
Mx+ (aq) + x e– → M (s) atau 2H2O + 2e– → H2 (g) + 2OH–
2. Ion positif dari lelehan golongan I A, II A, Al, dan Mn akan tereduksi.
Mx+ (l) + x e– → M (s)
Pada anoda-oksidasi :
1. Jika elektroda tidak inert, maka akan teroksidasi.
M (s) → Mx+ + x e–
2. Jika elektroda inert (Au, C, Pt), maka elektroda tersebut tidak akan teroksidasi. Yang teroksidasi adalah ion negatif dengan ketentuan sebagai berikut.
a. Apabila ion negatif berasal dari halogen (F–, Cl–, Br–, I–), maka akan teroksidasi.
2X– → X2 + 2e–
b. Apabila ion negatif berasal dari ion oksi (terdapat oksigen), seperti SO42-, NO3–, dan PO43-, maka tidak akan teroksidasi, yang teroksidasi adalah air.
2H2O → O2 (g) + 4H+ + 4e–
c. Apabila ion negatif hidroksida, maka akan teroksidasi.
4OH– → O2 (g) + 4H+ + 4e–
Baca juga Sifat Koligatif Larutan.
Contoh Soal Elektrolisis
Gambar dan tuliskan reaksi elektrolisis pada katoda dan anoda dari :
- Elektrolisis larutan CaCl2 dengan elektroda karbon (C).
- Elektrolisis larutan CuSO4 dengan elektroda tembaga (Cu).
- Elektrolisis lelehan NaCl dengan elektroda Platina (Pt).
1. Elektrolisis larutan CaCl2 dengan elektroda karbon (C).
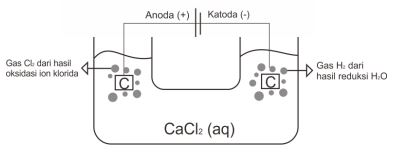
CaCl2 (aq) → Ca2+ (aq) + 2Cl– (aq)
Katoda-Reduksi : 2H2O + 2e–→ H2 (g) + 2OH–, karena ion positif dari larutan gol. II A.
Anoda-Oksidasi : 2Cl– (aq) → Cl2 (g) + 2e–, karena elektroda C inert, ion Cl– teroksidasi.
2. Elektrolisis larutan CuSO4 dengan elektroda tembaga (Cu).

CuSO4 (aq) → Cu2+ (aq) + SO42- (aq)
Katoda-Reduksi : Cu2+ (aq) + 2e– → Cu (s), karena ion positif dari larutan selain gol. I A, II A.
Anoda-Oksidasi : Cu (s) → Cu2+ (aq) + 2e–, karena elekroda tidak inert, maka Cu teroksidasi.
3. Elektrolisis lelehan NaCl dengan elektroda Platina (Pt).
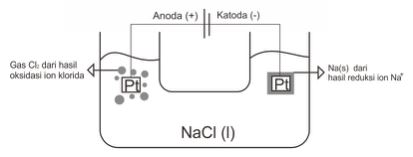
NaCl (l) → Na+ (l) + Cl– (l)
Katoda-Reduksi : Na+ (l) + e– → Na (s), karena ion positif dari lelehan gol. I A tereduksi.
Anoda-Oksidasi : 2Cl– (aq) → Cl2 (g) + 2e–, karena elektroda Pt inert, ion Cl– teroksidasi.
Demikian pembahasan mengenai elektrolisis. Semoga dapat bermanfaat. Baca juga Gas Mulia.
