Pernahkah kamu membuat es putar?
Saat membuat es putar, digunakan es yang dicampur dengan garam sebagai pendinginnya.
Mengapa demikian? Hal itu akan terjawab saat kita mempelajari materi sifat koligatif larutan.
Mari kita pelajari lebih lanjut tentang sifat koligatif larutan.
Pengertian Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat fisik larutan yang hanya bergantung pada jumlah partikel zat terlarut.
Sebelum mempelajari lebih lanjut, kita harus mengetahui jenis-jenis konsentrasi larutan terlebih dahulu, karena dalam perhitungannya akan banyak melibatkan rumus-rumus konsentrasi.
Berikut ini adalah beberapa jenis konsentrasi larutan.
1. Molaritas (M), adalah jumlah mol zat terlarut dalam 1 liter larutan.
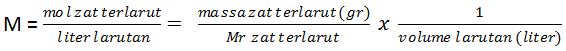
2. Molalitas (m), adalah jumlah mol zat terlarut dalam 1 kg pelarut.
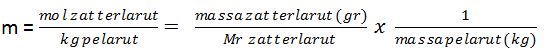
3. Fraksi mol (X), adalah perbandingan mol bagian dengan mol seluruh komponen.
Fraksi mol pelarut (Xp)
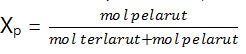
Fraksi mol terlarut (Xt)
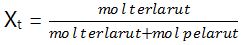
Xp + Xt = 1
Sifat koligatif larutan meliputi empat sifat, yaitu :
- Penurunan tekanan uap (∆P)
- Kenaikan titik didih (∆Tb)
- Penurunan titik beku (∆Tf)
- Tekanan osmotik (π)
Selanjutnya mari kita bahas satu per satu.
Baca juga Konfigurasi Elektron.
Penurunan Tekanan Uap (∆P)
Tekanan uap dari cairan murni bergantung pada jumlah molekul yang meninggalkan fase cair menjadi fase uap.
Jumlah partikel zat terlarut yang ditambahkan dalam cairan murni akan menjadi penghalang molekul cairan murni yang akan meninggalkan fase cair sehingga tekanan uap cairan murni (P⁰) lebih besar dari tekanan uap larutan (P).
Hal itu menunjukkan bahwa telah terjadi penurunan tekanan uap (∆P).
| Jika Larutan Non Elektrolit | Jika Larutan Elektrolit |
| ∆P = P⁰ – P | ∆P = P⁰ – P |
| P = Xp . P⁰ | P = Xp . P⁰ . i |
| ∆P = Xt . P⁰ | ∆P = Xt . P⁰ . i |
Dimana i = 1 + (n-1)α yang merupakan faktor Van’t Hoff
dengan derajat disosiasi, α = ![]() , dan n = jumlah koefisien ion-ion.
, dan n = jumlah koefisien ion-ion.
Kenaikan Titik Didih (∆Tb)
Jika partikel zat terlarut ditambahkan dalam suatu pelarut, maka akan menyebabkan kenaikan titik didih (∆Tb), dimana titik didih larutan (Tblarutan) lebih besar dari titik didih pelarut (Tbpelarut).
| Jika Larutan Non Elektrolit | Jika Larutan Elektrolit |
| ∆Tb = Tflarutan – Tfpelarut | ∆Tb = Tflarutan – Tfpelarut |
| ∆Tb = m . Kb | ∆Tb = m . Kb . i |
Dimana :
- m = molal
- Kb = tetapan titik didih
- i = faktor Van’t Hoff
Penurunan Titik Beku (∆Tf)
Jika zat terlarut ditambahkan dalam suatu pelarut, maka akan menyebabkan penurunan titik beku (∆Tf), dimana titik beku pelarut (Tfpelarut) lebih besar dari titik beku larutan (Tflarutan).
| Jika Larutan Non Elektrolit | Jika Larutan Elektrolit |
| ∆Tf = Tfpelarut – Tflarutan | ∆Tf = Tfpelarut – Tflarutan |
| ∆Tf = m . Kf | ∆Tf = m . Kf . i |
Dimana :
- m = molal
- Kf = tetapan titik beku
- i = faktor Van’t Hoff
Tekanan Osmotik (π)
Osmosis adalah peristiwa berpindahnya zat pelarut dari larutan yang lebih encer ke larutan yang lebih pekat melalui membran semipermeabel.
| Jika Larutan Non Elektrolit | Jika Larutan Elektrolit |
| π = M . R . T | π = M . R . T . i |
Dimana :
- π = tekanan osmotik (atm)
- M = molaritas
- R = tetapan gas ideal = 0,082 L.atm/mol.K
- T = suhu Kelvin
- i = faktor Van’t Hoff
Berdasarkan tekanan osmosik larutan, larutan terbagi menjadi tiga, yaitu :
- Larutan isotonik, adalah larutan yang memiliki tekanan osmotik sama.
- Larutan hipertonik, adalah larutan yang memiliki tekanan osmotik lebih besar.
- Larutan hipotonik, adalah larutan yang memiliki tekanan osmotik lebih kecil.
Baca juga Ikatan Hidrogen.
Contoh Soal Sifat Koligatif Larutan
1. Diketahui bahwa tekanan uap air murni sebesar 100 mmHg. Jika fraksi mol NaCl adalah 10%, maka besar penurunan tekanan uap adalah …
P⁰ = 100 mmHg
Xt = 10% = 0,1
∆P = … ?
∆P = Xt . P⁰
∆P = 0,1 . 100 mmHg
∆P = 10 mmHg
Jadi, tekanan uap turun sebesar 10 mmHg.
2. Larutan yang isotonik dengan C6H12O6 0,3 M adalah …
- KI 0,1 M
- CaCl2 0,1 M
- FeCl2 0,2 M
Larutan isotonik adalah larutan yang memiliki tekanan osmotik sama. Maka kita cari terlebih dahulu besar tekanan osmotik (π) dari C6H12O6 0,3 M (larutan non elektrolit).
π C6H12O6 = M . R . T
π C6H12O6 = 0,3 . 0,082 . T
π C6H12O6 = 0,0246 T
Selanjutnya kita cari larutan yang memiliki π sama dengan π C6H12O6, yaitu sebesar 0,0246 T.
KI 0,1 M (larutan elektrolit kuat, maka α = 1)
KI → K+ + I–
n = 2
π KI = M . R . T . i
π KI = 0,1 . 0,082 . T . (1+(n-1)α)
π KI = 0,0082 T . (1+(2-1)1)
π KI = 0,0164 T
CaCl2 0,1 M (larutan elektrolit kuat, maka α=1)
CaCl2 → Ca2+ + 2Cl–
n = 3
π CaCl2 = M . R . T . i
π CaCl2 = 0,1 . 0,082. T . (1+(n-1)α)
π CaCl2 = 0,0082 T . (1+(3-1)1)
π CaCl2 = 0,0246 T
FeCl2 0,2 M (larutan elektrolit kuat, maka α=1)
FeCl2 → Fe2+ + 2Cl–
n = 3
π FeCl2 = M. R . T . i
π FeCl2 = 0,2 . 0,082 . T . (1+(n-1)α)
π FeCl2 = 0,0164 T . (1+(3-1)1)
π FeCl2 = 0,0492 T
Jadi, larutan yang isotonik dengan C6H12O6 0,3 M adalah larutan CaCl2 0,1 M.
3. Tekanan uap jenuh air pada suhu 28⁰C adalah 100 mmHg. Apabila 30 gram urea (Mr=60) dilarutkan dalam 2 mol air tersebut, maka tekanan uap larutan pada suhu yang sama sebesar … mmHg.
P⁰ air = 100 mmHg
Mr urea = 60 gram/mol
Massa urea = 30 gram
n. air = 2 mol
P = … ?
P = Xp . P⁰
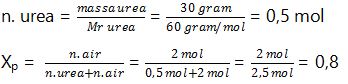
P = Xp . P⁰
P = 0,8 . 100 mmHg
P = 80 mmHg
Jadi, tekanan uap larutan urea tersebut sebesar 80 mmHg.
Demikian pembahasan mengenai sifat koligatif larutan. Semoga dapat bermanfaat. Baca juga Larutan Penyangga.
