Ikatan kimia adalah gaya yang mampu mengikat atom-atom pada molekul atau gabungan ion pada suatu senyawa.
Ikatan kimia terbentuk karena setiap atom memiliki kecenderungan untuk memiliki susunan elektron yang stabil seperti gas mulia yang memiliki elektron di kulit terluar (elektron valensi) berjumlah dua/duplet dan berjumlah 8/oktet.
Atom atau unsur yang belum stabil memiliki beberapa cara untuk mencapai kestabilan, yaitu dengan melepaskan elektron, menangkap elektron, maupun menggunakan pasangan elektron secara bersama.
Mari kita pelajari lebih lanjut.
Ikatan Ion
Ikatan ion adalah ikatan yang terjadi antara ion positif (kation) dengan ion negatif (anion) yang melakukan perpidahan atau serah terima elektron dari atom yang satu ke atom yang lainnya. Ikatan ion dapat terjadi antara :
- Kation dengan anion
- Atom unsur yang memiliki energi ionisasi rendah (gol. IA dan IIA) dengan atom unsur yang memiliki afinitas elektron tinggi (gol. VIA dan VIIA)
- Unsur logam dengan non logam
Contoh Ikatan Ion
Ikatan dalam senyawa CaCl2
Konfigurasi elektron Ca : 2 8 8 2, elektron valensi = 2
Konfigurasi elektron Cl : 2 8 7, elektron valensi = 7
Agar kedua atom tersebut stabil, maka atom Ca cenderung melepas 2 elektron membentuk Ca2+ dan atom Cl cenderung menerima 1 elektron membentuk Cl–.
Ca (2 8 8 2) → Ca2+ + 2e–
Cl (2 8 7) + 1e– → Cl– (2x)
Reaksi : Ca + 2Cl → Ca2+ + 2Cl– → CaCl2
Baca juga Tata Nama Senyawa.
Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi karena adanya penggunaan pasangan elektron secara bersama dari atom-atom yang berikatan sehingga menjadi stabil.
Penggunaan elektron secara bersama digambarkan dalam bentuk titik elektron (.), tanda silang (x), ataupun bulatan kecil (•).
Tanda-tanda tersebut merupakan rumus elektron atau titik elektron yang menggambarkan elektron valensi masing-masing atom yang berikatan.
Berdasarkan bentuk ikatannya, ikatan kovalen terbagi menjadi ikatan kovalen normal dan ikatan kovalen koordinasi.
1. Ikatan Kovalen Normal
Ikatan kovalen normal terjadi karena adanya penggunaan pasangan elektron secara bersama, dimana elektronnya berasal dari kedua atom yang berikatan.
Jumlah ikatannya dapat diramalkan dengan menghitung jumlah pasangan elektron yang digunakan bersama, serta jumlah dan jenis atom yang membentuk molekul.
Oleh karena itu, terdapat ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga.
Contoh Ikatan Kovalen Tunggal
Ikatan dalam molekul Cl2
Konfigurasi elektron Cl : 2 8 7, elektron valensi = 7

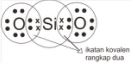
Contoh Ikatan Kovalen Rangkap Dua
Ikatan dalam molekul SiO2
Konfigurasi elektron Si : 2 8 4, elektron valensi = 4
Konfigurasi elektron O : 2 6, elektron valensi = 8
Contoh Ikatan Kovalen Rangkap Tiga
Ikatan dalam molekul N2
Konfigurasi elektron N : 2 5, elektron valensi = 5

2. Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi adalah ikatan yang terjadi karena penggunaan pasangan elektron bersama, namun pasangan elektron tersebut hanya berasal dari salah satu atom yang berikatan.
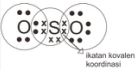
Contoh Ikatan Kovalen Koordinasi
Ikatan dalam molekul SO2
Konfigurasi elektron S : 2 8 6, elektron valensi = 6
Konfigurasi elektron O : 2 6, elektron valensi = 6
Ikatan Logam
Elektron valensi pada atom-atom unsur logam mudah lepas karena memiliki keelektronegatifan yang rendah dan energi ionisasi yang kecil.
Hal itu menyebabkan atom-atom tersebut akan berubah menjadi ion positif yang berada di tengah lautan elektron yang bergerak bebas dan saling tarik menarik.
Interaksi tarik menarik itulah yang disebut ikatan logam.
Baca juga Laju Reaksi.
Contoh Soal Ikatan Kimia
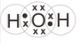
1. Apakah ikatan yang terbentuk pada molekul air (H2O)?
Kedua unsur adalah unsur non logam
Konfigurasi elektron H : 1, elektron valensi = 1
Konfigurasi elektron O : 2 6, elektron valensi = 6
Jawaban : Ikatan kovalen tunggal
2. Berikut ini yang tidak mengikuti kaidah duplet atau oktet adalah…
- a. CH4
- b. PCl3
- c. PCl5
Kaidah duplet adalah susunan elektron yang stabil dimana suatu atom memiliki elektron di kulit terluar berjumlah dua.
Sedangkan kaidah oktet adalah susunan elektron yang stabil dimana suatu atom memiliki elektron di kulit terluar berjumlah delapan.
a. CH4
Konfigurasi elektron C : 2 4, elektron valensi = 4
Konfigurasi elektron H : 1, elektron valensi = 1
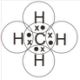
Molekul CH4 memenuhi kaidah duplet dan oktet.
b. PCl3
Konfigurasi elektron P : 2 8 5, elektron valensi = 5
Konfigurasi elektron Cl : 2 8 7, elektron valensi = 7

Molekul PCl3 memenuhi kaidah oktet.
c. PCl5
Konfigurasi elektron P : 2 8 5, elektron valensi = 5
Konfigurasi elektron Cl : 2 8 7, elektron valensi = 7

Molekul PCl5 tidak memenuhi kaidah duplet atau oktet karena atom P dikelilingi oleh 10 elektron.
Jawaban : c. PCl5
Demikian pembahasan mengenai ikatan kimia. Semoga dapat bermanfaat. Baca juga Termokimia.
