Pada mulanya, atom dianggap sebagai materi yang terdiri atas partikel-partikel kecil yang sudah tidak dapat dibagi-bagi lagi.
Namun seiring perkembangannya, para ilmuwan menemukan bahwa dalam atom masih terdapat partikel-partikel yang menyusunnya, yaitu elektron, proton, dan neutron.
Untuk mengetahui lebih lanjut, mari kita bahas bersama-sama bab berikut ini.
Pengertian Struktur Atom
Struktur atom merupakan unit dasar materi yang terdiri dari inti atom dan awan elektron yang memiliki muatan negatif (-) di sekelilingnya.
Inti atom terdiri dari proton yang memiliki muatan positif dan neutron yang memiliki muatan netral.
Elektron yang berada di sekeliling inti atom terikat oleh gaya elektrostatik.
Elektron
Elektron ditemukan oleh J.J. Thompson melalui percobaan sinar katode.
Dari percobaannya, diperoleh bahwa elektron tidak memiliki massa dan bermuatan elektron -1, dilambangkan:
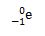
Proton
Proton ditemukan oleh Eugene Goldstein melalui percobaan yang menghasilkan sinar anode.
Dari percobaannya, diperoleh bahwa proton memiliki massa 1 sma (satuan massa atom) dan memiliki muatan +1, dilambangkan dengan:
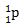
Inti Atom
Inti atom ditemukan oleh Ernest Rutherford melalui percobaan penghamburan sinar alfa.
Dari percobaannya, diperoleh bahwa inti atom bermuatan positif yang dikelilingi oleh elektron yang bermuatan negatif.
Neutron
Neutron ditemukan oleh James Chadwick melalui percobaan penembakan partikel alfa pada inti atom dan dihasilkan radiasi partikel berdaya tembus tinggi yang bersifat netral, namun memiliki massa hampir sama dengan proton.
Massa 1 neuton adalah 1,675 x 10-24 gram. Neutron dilambangkan dengan:
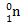
Dalam penulisan atom, nomor atom (Z) dituliskan di sebelah kiri bawah, sedangkan nomor massa (A) dituliskan di sebelah kiri atas dari lambang atom.
Berikut ini merupakan lambang atom.
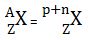
dimana :
- X = lambang unsur
- Z = nomor atom = jumlah proton
- A = nomor massa = inti atom = jumlah proton + neutron
Baca juga Termokimia.
Massa Atom
Atom adalah partikel penyusun zat yang memiliki ukuran sangat kecil sehingga massa satu atom terlalu kecil apabila digunakan dalam perhitungan.
Oleh karena itu, massa atom dinyatakan dengan satuan massa atom (sma) dimana 1 sma sama dengan 1/12 kali massa 1 atom ![]() netral, yaitu sebesar 1,66053886 x 10-27 kg.
netral, yaitu sebesar 1,66053886 x 10-27 kg.
Massa atom ditentukan oleh jumlah nukleon (proton + neutron).
Massa Atom Relatif
Massa atom relatif (Ar) adalah massa rata-rata dari isotop-isotop unsur tertentu dalam satuan massa atom (sma) sesuai kelimpahannya di alam (%).
Misalnya, atom ![]() memiliki kelimpahan di alam sebesar 99,985% dan atom
memiliki kelimpahan di alam sebesar 99,985% dan atom ![]() memiliki kelimpahan di alam sebesar 0,015%, maka massa atom relatifnya dapat dihitung sebagai berikut.
memiliki kelimpahan di alam sebesar 0,015%, maka massa atom relatifnya dapat dihitung sebagai berikut.
Massa Atom Relatif (Ar H) = (massa ![]() x persentase kelimpahan di alam) + ( massa
x persentase kelimpahan di alam) + ( massa ![]() x persentase kelimpahan di alam)
x persentase kelimpahan di alam)
Massa Atom Relatif (Ar H) = (1,0078 sma x 99,985%) + (2,0141 sma x 0,015%)
Massa Atom Relatif (Ar H) = 1,0076 sma + 0,003 sma
Massa Atom Relatif (Ar H) = 1,0079 sma
Jadi, Ar H adalah 1,0079 sma.
Baca juga Hukum Faraday.
Isotop
Isotop adalah kelompok unsur yang memiliki nomor atom sama, namun nomor massa berbeda. Contoh :
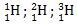
Isobar
Selain isotop, terdapat juga istilah isobar dan isoton. Isobar adalah kelompok unsur yang memiliki nomor massa sama, namun nomor atom berbeda. Misalnya:
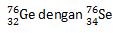
Isoton
Sedangkan isoton adalah kelompok unsur yang memiliki jumlah neutron sama. Misalnya:
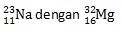
Contoh Soal Struktur Atom
Di alam, atom Oksigen memiliki tiga isotop, yaitu ![]() dengan kelimpahan 99,76%;
dengan kelimpahan 99,76%; ![]() dengan kelimpahan 0,04% ; dan
dengan kelimpahan 0,04% ; dan ![]() dengan kelimpahan 0,20%.
dengan kelimpahan 0,20%.
Massa atom (sma) dari masing-masing isotop secara berturut-turut adalah 15,9949 sma, 16,9991 sma, dan 17,9992 sma. Tentukan massa atom relatif Oksigen.
Ar O = (massa ![]() x persentase kelimpahan
x persentase kelimpahan ![]() ) + (massa
) + (massa ![]() x persentase kelimpahan
x persentase kelimpahan ![]() ) + (massa
) + (massa ![]() x persentase kelimpahan
x persentase kelimpahan ![]() )
)
Ar O = (15,9949 x 99,76%) + (16,9991 x 0,04%) + (17,9992 x 0,20%)
Ar O = 15,957 sma + 0,007 sma + 0,036 sma
Ar O = 16 sma
Jadi, massa atom relatif dari atom oksigen adalah 16 sma.
Demikian pembahasan mengenai struktur atom. Semoga dapat bermanfaat. Baca juga Minyak Bumi.
