Apakah sebelumnya kalian pernah mempelajari tentang bilangan kuantum?
Jika pernah, pengetahuan tentang bilangan kuantum tersebut akan sangat berguna untuk mempelajari materi konfigurasi elektron pada kali ini.
Apa yang dimaksud konfigurasi elektron? Mari kita bahas bersama-sama.
Pengertian Konfigurasi Elektron
Konfigurasi elektron adalah susunan elektron pada subkulit atom dalam orbital atom atau molekulnya.
Harus diingat bahwa masing-masing orbital memiliki batas elektron yang dapat mengisinya. Berikut penjelasannya.
- Orbital s mampu diisi 2 elektron
- Orbital p mampu diisi 6 elektron
- Orbital d mampu diisi 10 elektron
- Orbital f mampu diisi 14 elektron
Aturan Penulisan Konfigurasi Elektron
Ada beberapa aturan yang digunakan untuk menuliskan konfigurasi elektron , yaitu :
1. Asas Aufbau
Berdasarkan asas Aufbau, pengisian elektron pada orbital dimulai dari subkulit yang memiliki tingkat energi lebih rendah ke tingkat energi yang lebih tinggi.
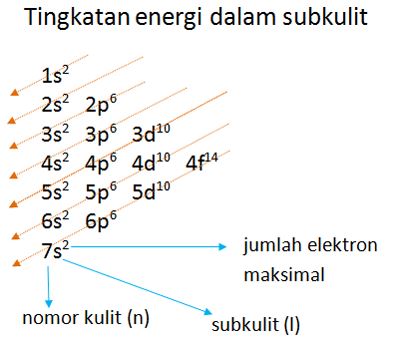
Contoh :
12Mg = 1s2 2s2 2p6 3s2
23V = 1s2 2s2 2p6 3s2 3p6 4s2 3d3
2. Aturan Hund
Berdasarkan aturan Hund, jika elektron tersebar dalam orbital dengan tingkat energi yang sama, elektron tidak akan berpasangan sebelum orbital tersebut terisi penuh.
Contoh :
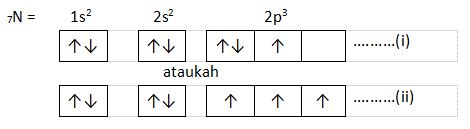
Manakah pernyataan di atas yang memenuhi aturan Hund?
Yang memenuhi aturan Hund adalah penulisan pada nomor (ii), karena elektron harus mengisi seluruh orbital terlebih dahulu sebelum berpasangan.
3. Larangan Pauli
Berdasarkan larangan Pauli, dalam suatu atom tidak boleh terdapat dua elektron yang memiliki keempat bilangan kuantum (n, l, m, dan s) yang sama. Jika dua elektron menempati orbital yang sama, maka bilangan kuantum spin dua elektron ini harus berbeda.
Contoh :
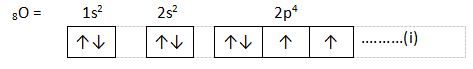
Pada orbital 2p4, masing-masing elektron pada orbital tersebut memiliki keempat bilangan kuantum yang tidak sama.
Untuk bilangan kuantum subkulit ke -5, n = 2, l = 1, m = -1, s = +½
Untuk bilangan kuantum subkulit ke-6, n = 2, l = 1, m = 0, s = +½
Untuk bilangan kuantum subkulit ke-7, n = 2, l = 1, m = 1, s = +½
Untuk bilangan kuantum subkulit ke-8, n = 2, l = 1, m = -1, s = -½
Baca juga Larutan Elektrolit dan Non Elektrolit.
Konfigurasi Elektron Gas Mulia
Gas mulia adalah unsur-unsur yang memiliki kestabilan yang sangat tinggi dan dalam sistem periodik terdapat pada golongan VIIIA.
Gas mulia terdiri dari He (Helium), Ne (Neon), Ar (Argon), Kr (Kripton), Xe (Xenon), Rn (Radon). Sebagian unsur ini ditemukan di alam sebagai unsur monoatomik.
Hal penting yang menyebabkan gas mulia memiliki kesatabilan yang sangat tinggi adalah konfigurasi elektronnya.
Berikut ini adalah konfigurasi elektron dari unsur gas mulia.
2He = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
10Ne = 1s2 2s2 2p6
18Ar = 1s2 2s2 2p6 3s2 3p6
36Kr = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
86Rn = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
Konfigurasi elektron gas mulia biasa digunakan untuk menyingkat penulisan konfigurasi elektron unsur yang lain. Misalnya, penulisan elektron unsur 21Sc.
21Sc = 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Jika disingkat maka menjadi
21Sc = [Ar] 3d1 4s2
Baca juga Hidrolisis.
Contoh Soal Konfigurasi Elektron
1. Unsur X mengandung 11 elektron sehingga memiliki konfigurasi elektron …
1s2 2s2 2p6 3s1
2. Deret bilangan kuantum yang sesuai untuk elektron terakhir pada orbital 3d5 adalah …
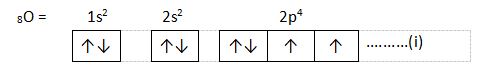
n = 3, l = 2, m = +2, s = + ½
3. Tentukan jumlah elektron maksimum dalam suatu atom yang memiliki bilangan kuantum
n = 4, l = 2, dan m = 1.
n = 4, artinya elektron menempati kulit ke-4
l = 2, artinya elektron menempati subkulit d
m = 1 artinya elektron menempati orbital d yang ke-4
Jadi, dengan bilangan kuantum tersebut, orbital yang dimaksud dapat 3d4 (minimum) atau 3d9 (maksimum). Sehingga jumlah elektron maksimum dalam atom dengan konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s2 3d9 atau 1s2 2s2 2p6 3s2 3p6 4s1 3d10 adalah 29.
Demikian pembahasan mengenai konfigurasi elektron. Semoga dapat bermanfaat. Baca juga Hidrokarbon.
