Reaksi redoks (oksidasi-reduksi) merupakan proses-proses elektrokimia, dimana reaksinya melibatkan hubungan antara listrik dan reaksi kimia.
Ingin tahu lebih lanjut mengenai reaksi redoks? Mari kita bahas bersama bab berikut ini.
Pengertian Reaksi Redoks
Reaksi redoks reaksi kimia yang terdiri dari setengah reaksi oksidasi dan setengah reaksi reduksi yang disertai dengan adanya perubahan bilangan oksidasi (biloks) baik pada reaktan maupun produk.
Reaksi oksidasi ditandai dengan adanya pengikatan oksigen, pelepasan elektron, atau kenaikan biloks.
Sedangkan reaksi reduksi ditandai dengan adanya pelepasan oksien, penangkapan elektron, atau penurunan biloks.
Unsur atau senyawa yang mengalami oksidasi disebut reduktor, sedangkan unsur atau senyawa yang mengalami reduksi disebut oksidator.
Berikut ini adalah nilai biloks dari :
- Unsur bebas (misal O2, Al, dan Fe) = 0
- Unsur H dalam senyawa = +1; kecuali dalam hidrida = -1
- Unsur O dalam senyawa = -2; kecuali dalam peroksida = -1, dan dalam oksifluorida = +2
- Unsur logam dalam senyawa = jumlah elektron valensi (+)
- Unsur non logam dalam senyawa biner = gol. VI A (biloks = -2); gol. VII A (biloks = -1)
- Biloks total dalam senyawa = 0
- Biloks dari ion tunggal maupun ion poliatomik = jumlah muatan
Dalam reaksi redoks, terdapat senyawa yang mengalami reaksi oksidasi sekaligus reduksi sehingga reaksi itu disebut reaksi autoredoks (disproporsionasi).
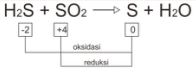
Ada juga reaksi redoks dimana hasil oksidasi sama dengan hasil reduksi, sehingga reaksi itu disebut reaksi konproporsionasi.
Contoh reaksi autoredoks (disproporsionasi)
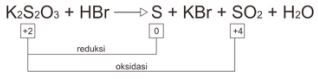
Contoh reaksi konproporsionasi
Baca juga Hidrolisis.
Penyetaraan Reaksi Redoks
Dalam reaksi redoks perlu dilakukan penyetaraan jumlah atom dan jumlah muatan pada reaktan dan produk.
Terdapat dua cara untuk menyetarakannya, yaitu dengan cara bilangan oksidasi dan cara setengah reaksi.
Bilangan Oksidasi
Langkah-langkah :
- Menandai unsur yang mengalami perubahan biloks, disamakan jumlah atomnya.
- Menentukan biloks unsur yang berubah, dihitung perubahan dan disamakan jumlahnya.
- Menyetarakan kation, anion, hidrogen, dan oksigen (jika ada).
- Menyamakan muatan. Apabila reaksi asam, maka ditambah H+ dan disetarakan dengan H2O; apabila reaksi basa, maka ditambah OH– dan disetarakan dengan H2O.
Setengah Reaksi
Langkah-langkah :
- Menuliskan ion-ion yang mengalami oksidasi dan reduksi secara terpisah.
- Menyamakan jumlah atom-atom yang mengalami perubahan biloks.
- Selisih biloks dikali jumlah atom = jumlah elektron.
- Jumlah elektron ditulis di kiri jika reaksi reduksi, sedangkan ditulis di kanan jika reaksi oksidasi.
- Jumlah elektron di kiri dan kanan disetarakan.
- Jumlah muatan di kiri dan kanan disetarakan dengan penambahan H+ (suasana asam) dan atau OH– (suasana basa).
- Menyetarakan jumlah atom dengan menambahkan H2O.
Baca juga Laju Reaksi.
Contoh Soal Reaksi Redoks
1. Tentukan biloks dari masing-masing unsur dalam senyawa berikut.
- SO42-
- NaNO3
SO42– = ion poliatomik
Biloks dari ion poliatomik = jumlah muatan = -2
Biloks O dalam senyawa = -2
Biloks S + 4 . biloks O = -2
-6 + 4 . (-2) = -2
Jadi, biloks S = -6 dan biloks O = -2.
NaNO3 = senyawa tak bermuatan
Biloks total = 0
Biloks O dalam senyawa = -2
Biloks Na (logam) = jumlah elektron valensi = +1
Biloks Na + biloks N + 3 . biloks O = 0
+1 + (+5) + 3 . (-2) = 0
Jadi, biloks Na = +1, biloks N = +5, dan biloks O =-2
Baca juga Termokimia.
2. Tentukan unsur atau senyawa yang manakah yang merupakan oksidator, reduktor, hasil oksidasi, dan hasil reduksi dari reaksi kimia berikut ini.
Fe + HCl → FeCl3 + H2
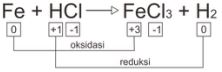
Oksidator (mengalami reduksi) = HCl
Reduktor (mengalami oksidasi) = Fe
Hasil oksidasi = FeCl3
Hasil reduksi = H2
3. Setarakan persamaan reaksi redoks berikut dengan cara bilangan oksidasi dan cara setengah reaksi.
Bi2O3 + ClO– → 2BiO3– + Cl– (suasana basa).
Cara Bilangan Oksidasi

- Disamakan muatan kiri dan kanan : 2OH– + Bi2O3 + ClO– → 2BiO3– + Cl–
- Disamakan jumlah atom-atomnya : 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Reaksi Setara : 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Cara Setengah Reaksi
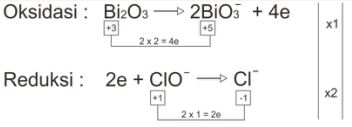
Redoks : Bi2O3 + 2ClO– → 2BiO3– + 2Cl–
- Setarakan muatan dengan menambahkan OH– (basa).
2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl–
- Setarakan jumlah atom dengan menambahkan H2O.
2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Reaksi Setara : 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Demikian pembahasan mengenai reaksi redoks (oksidasi-reduksi). Semoga dapat bermanfaat. Baca juga Ikatan Kimia.
