Hukum Faraday adalah ilmu yang mempelajari mengenai dasar elektromagnetisme yang merupakan proses perubahan kimia menghasilkan arus listrik maupun sebaliknya.
Hukum ini dikemukakan oleh Michael Faraday, seorang ilmuwan asal Inggris yang bekerja dalam bidang elektrolisis.
Untuk mengetahui lebih lanjut mengenai hukum Faraday, mari kita pelajari bersama bab berikut ini.
Hukum 1 Faraday
Hukum 1 Faraday berbunyi, “Massa zat yang dihasilkan oleh suatu elektrode selama elektrolisis(W) akan berbanding lurus dengan jumlah muatan listrik yang akan digunakan (Q)”. Berikut ini merupakan persamaan untuk menyatakan Hukum 1 Faraday.
W ~ Q
Jumlah muatan listrik yang digunakan (Q) sama dengan hasil kali antara kuat arus listrik (i) dan selang waktu (t).
Q = i × t
Berdasarkan eksperimen, 1 mol elektron sama dengan 1 Faraday yang memiliki muatan listrik sebesar 96.500 Coulomb. Hubungan tersebut dapat dirumuskan sebagai berikut.
Q = ne × F
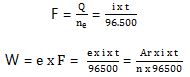
dimana :
- W = massa zat yang dihasilkan (gram)
- e = massa ekivalen zat
- i = kuat arus listrik (Ampere)
- t = selang waktu (detik)
- Ar = massa atom relatif
- n = valensi zat
Hukum 2 Faraday
Hukum 2 Faraday berbunyi, “Massa zat yang dihasilkan oleh suatu elektrode selama elektrolisis (W) akan berbanding lurus dengan massa ekivalen zat yang digunakan (e)”.
Massa ekivalen zat merupakan perbandingan dari massa atom relatif (Ar) dengan valensinya. Hukum 2 Faraday dapat dirumuskan sebagai berikut.
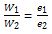
Baca juga Ikatan Kimia.
Contoh Soal Hukum Faraday
1. Jumlah faraday untuk mereduksi ion Ca2+ sebanyak 12 gram adalah…
Ca2+ → valensi = 2
Ar Ca = 40
W = e x F
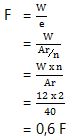
Jadi, untuk mereduksi 12 gram ion Ca2+ diperlukan 0,6 Faraday.
2. Pada elektrolisis dengan elektroda karbon dihasilkan endapan Cu sebanyak 12,7 gram dengan arus listrik yang digunakan sebesar 4 A. Berapa lama waktu yang diperlukan untuk elektrolisis tersebut?
Ar Cu = 63,5

Jadi, lama waktu yang diperlukan untuk elektrolisis adalah 9650 detik.
3. Larutan Cu dapat membebaskan 7,95 gram logam Cu jika dialirkan sejumlah arus listrik. Berapa Ag yang dibebaskan dari larutan Ag+ jika dialirkan dengan jumlah arus listrik yang sama? (Diketahui Ar Cu = 63,5 dan Ar Ag = 108)
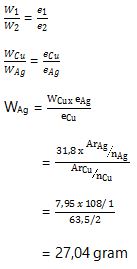
Jadi, jumlah Ag yang dihasilkan sebesar 27,04 gram.
Demikian pembahasan mengenai Hukum Faraday. Semoga dapat bermanfaat. Baca juga Reaksi Redoks (Oksidasi-Reduksi).
