Assalammualaikum temen-temen
Kalian pernah merebus air menggunakan ketel/ panci?
Lalu, Apakah yang terjadi pada air ?
Kira-kira apa makna fisis dari kejadian tersebut ?
Nah berikut penjelasannya ya
Ketika ketel diletakkan di atas kompor, maka ketel akan panas dan suhu air didalam ketel juga akan naik. Hal tersebut kita katakan bahwa kalor mengalir dari kompor ke ketel dan air.
Kesimpulannya air mendapatkan kalor dari kompor dengan perantara ketel/panci.
Makna fisisnya, Ketika dua benda yang memiliki suhu berbeda diletakkan saling bersentuhan, maka kalor akan mengalir dari benda yang suhunya tinggi ke benda yang suhunya rendah. Aliran kalor akan cenderung mneyamakan suhu.
Sehingga benda yang disentuhkan cukup lama, maka suhu keduanya akan sama atau dalam keadaan setimbang termal dan tidak ada lagi kalor yang mengalir.
Perlu hati-hati ya dalam pemahaman suhu, dan kalor. Walaupun keduanya berkaitan tetapi memiliki makna fisis yang berbeda.
Untuk kali ini kita akan membahas KALOR sampai tuntas
Jadi, simak ya!
Pengertian Kalor
Kalor adalah salah satu bentuk energi, sehingga dapat berpindah dari satu sistem ke sistem yang lain karena adanya perbedaan suhu.
Setiap ada perbedaan suhu antara dua sistem maka akan terjadi perpindahan kalor. Kecenderungan perpindahan kalor dari suhu tinggi ke suhu rendah.
Ketika zat mengalami pemanasaan, partikel-partikel benda akan bergetar dan menumbuk partikel lain yang suhunya lebih rendah.
Hal ini berlangsung lama akan membentuk energi kinetik rata-rata sama antara benda panas dengan benda yang menerima panas.
Kondisi seperti ini terjadi kesetimbangan termal dan suhu kedua benda akan sama.
Satuan kalor dalam S.I. adalah Joule dan dalam CGS adalah erg.
1 Joule = 107 erg.
Sebelum orang mengetahui bahwa kalor merupakan suatu bentuk energi, maka orang sudah mempunyai satuan untuk kalor adalah kalori.
1 kalori = 4,18 joule atau 1 Joule = 0,24 kal.
Perpindahan Kalor
Perpindahan kalor adalah proses perpindahan panas dari reservoir suhu tinggi ke reservoir suhu rendah.
Dalam hal sistem termodinamika, perpindahan panas adalah perpindahan panas melintasi batas sistem karena perbedaan suhu antara sistem dan lingkungan.
Perpindahan panas juga dapat terjadi di dalam sistem karena perbedaan suhu di berbagai titik di dalam sistem.
Perbedaan suhu dianggap ‘potensial’ yang menyebabkan aliran panas dan panas itu sendiri disebut fluks.
Terdapat tiga jenis perpindahan kalor yaitu konduksi, konveksi, dan Radiasi. Berikut ini adalah penjelasan dari ketiga jenis perpindahan kalor :
1. Konduksi
Konduksi adalah Perpindahan panas antara dua benda padat. Hal tersebut tergantung pada perbedaan suhu suatu sistem/benda yang panas dan dingin.
Perpindahan panas(kalor) konduksi pada suatu zat tidak disertai dengan perpindahan partikel – partikelnya.
Contoh :
- memanaskan salah satu ujung logam seperti tembaga; karena perpindahan panas konduksi ujung logam yang lain juga menjadi panas.
- Knalpot yang panas ketika motor dinyalakan
rumus konduksi
Laju Kalor = Q/t = kA ΔT/x
keterangan:
- Q : kalor (J) atau (kal)
- k : konduktivitas termal (W/mK)
- A : luas penampang (m2)
- ΔT : perubahan suhu (K)
- x : panjang (m)
- t : waktu (sekon)
Baca juga Hukum Pascal.
2. Konveksi
Konveksi adalah Perpindahan panas antara permukaan padat dan cairan. Jika partikelnya berpindah dan mengakibatkan kalor merambat, maka akan terjadilah konveksi.
Contoh :
- Bejana panas yang dicelupkan kedalam air, maka air akan menjadi panas/hangat akibat terjadinya konveksi
- Peristiwa terjadinya angin darat dan angin laut.
- Asap cerobong pabrik yang membumbung tinggi.
Rumus konveksi
Laju Kalor = Q/t = hA ΔT
keterangan:
- h = koefisien konveksi termal (j/sm2K)
- A = Luas permukaan (m2)
- ∆ T = Perbedaan suhu (K)
3. Radiasi
Ketika dua benda berada pada suhu yang berbeda dan dipisahkan oleh jarak, perpindahan panas di antara keduanya disebut sebagai perpindahan panas radiasi.
Dalam hal perpindahan panas konduksi dan konveksi ada media untuk memindahkan panas, tetapi dalam kasus perpindahan panas radiasi tidak ada media.
Perpindahan panas radiasi terjadi karena gelombang elektromagnetik yang ada di atmosfer.
Salah satu contoh terpenting perpindahan panas radiasi adalah panas matahari yang datang ke bumi.
Rumus radiasi
Laju Kalor = Q/t = σeAT4
Rumus Kalor
Pada abad ke-18, sejumlah ilmuwan melakukan percobaan dan menemukan bahwa besar kalor Q yang diperlukan untuk mengubah suhu suatu zat yang besarnya ΔT sebanding dengan massa m zat tersebut. Pernyataan tersebut dapat dinyatakan dalam persamaan :
Q = m c ∆T
Keterangan :
- Q = banyaknya kalor yang diperlukan ( J)
- m = massa suatu zat yang diberi kalor (kg)
- c = kalor jenis zat (J/kg°C)
- ΔT = kenaikan/perubahan suhu zat (°C)
c adalah besaran karakteristik dari zat yang disebut kalor jenis zat. Kalor jenis suatu zat dinyatakan dalam satuan J/kg°C (satuan SI yang sesuai) atau kkal/kg°C. Untuk air pada suhu 15 °C dan tekanan tetap 1 atm, cair = 1 kkal/kg°C = 4,19 × 103 J/kg°C.
Baca juga Getaran.
Asas Black
Kalor yang dilepas oleh benda yang bersuhu tinggi sama dengan kalor yang diterima oleh benda yang bersuhu rendah. Hal ini dapat dinyatakan dalam persamaan :
Q lepas = Q terima
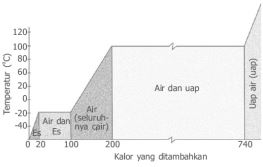
Kalor yang diperlukan untuk mengubah 1 kg zat dari padat menjadi cair disebut kalor lebur (Lb), kalor yang dibutuhkan untuk mengubah suatu zat dari wujud cair menjadi uap disebut kalor penguapan (Lu).
Kalor yang diberikan ke suatu zat untuk peleburan atau penguapan disebut kalor laten.
Rumus Kapasitas Kalor dan Kalor jenis
Sejumlah kalor yang diberikan suatu benda tidak semuanya mengalami kenaikan suhu, artinya masih bisa mengalami penurunan suhu.
Oleh karena itu, kalor dipengaruhi oleh beberapa faktor yaitu massa, selisih suhu dan kalor jenis.
Kalor jenis adalah kalor yang diperlukan untuk menaikkan suhu 1 kg suatu zat sebesar 1°C. kalor jenis yang diberi lambang “c”.
Jika suatu zat yang massanya m memerlukan atau melepaskan kalor sebesar Q untuk mengubah suhunya sebesar ΔT, maka kalor jenis zat itu dapat dinyatakan dengan persamaan:
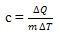
selain kalor jenis, juga dikenal istilah kapasitas kalor. Kapasitas kalor adalah banyaknya kalor yang diperlukan untuk menaikkan suhu suatu benda sebesar 1°C. kapasitas kalor diberi lambang “C”. persamaan kapasitas kalor bisa dinyatakan dengan :
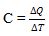
atau
∆Q = C x ∆T
Sehingga
C = m x c
Baca juga Gaya Normal.
Contoh Soal Kalor
1. Tentukan besar kalor yang diperlukan untuk menaikkan suhu sebatang alumunium yang massanya 10 kg dari 15 °C menjadi 100 ° C, jika kalor jenis besi 550 J/kg?
Diketahui :
m = 10 kg
∆T = 100-15 = 85 °C
C = 550 J/kg
Ditanyakan :
Q = … ?
Dijawab :
∆Q = m x c x ∆T
∆Q = 10 x 550 x 85
∆Q = 467500 J atau 467.5 Kj
2. Sepotong logam yang memiliki massa 4 kg, dipanaskan dari suhu 25°C hingga 135°C. Jika kalor yang diserap 125 kJ. Tentukan kapasitas kalor logam dan kalor jenis logam?
Diketahui :
m= 4 kg
∆T = 135-15 = 120 °C
Q = 125 kJ.
Ditanyakan :
- C …?
- c….?
jawab :
1. Kapasitas Kalor logam
C = Q / ∆T = 125000/ 120 = 1041, 667 J/°C
2. Kalor Jenis Logam
c = C/m = 1041.667 / 4 kg = 260.416 J/kg°C
3. Sebuah calorimeter dengan kapasitas 80 J/°C mula-mula diisi dengan 200 gram air dengan suhu 100°C. Kemudian calorimeter dimasukkan lagi sebuah logam yang bermassa 100 gram dengan suhu 40 °C. setelah tercapai kesetimbangan termal diperoleh suhu akhir campuran 60 °C. berapa kalor jenis logam tersebut? (kalor jenis air = 1 kal/gr °C). (1 J = 0.24 kal).
Diketahui :
Ck = 80 J/°C = 19.2 kal/°C
Ma = 200 gram
Ca = 1 kal/gr °C
mL = 75 gram
Ditanya : cL…?
Jawab
Kalor yang dilepas oleh
Calorimeter
Q1 = Ck x ∆T
Q1 = 19.2 (100-60)
Q1 = 768 KAL
Air :
Q2 = ma x ca x ∆T
Q2 = 200 x 1 x (100-0)
Q2 = 8000 kal
Kalor yang diserap logam
Q3 = Ml x cL x ∆T
Q3 = 100 x cL x (60-40)
Q3 = 2000 cL
Asas Black
Q1 + Q2 =Q3
768 +8000 = 2000 cL
8768 = 2000 cl
Cl = 4.384 kal/ gr °C
Demikian pembahasan tentang Kalor. Semoga bermanfaat. Baca juga Fisika Kuantum.
