Pernahkah kalian mendengar bahwa ada larutan yang dapat menghantarkan arus listrik?
Ya, memang ada. Larutan itu disebut larutan elektrolit. Namun, bagaimana cara kalian mengetahui apakah larutan tersebut bersifat elektrolit atau tidak (non elektrolit)?
Mari kita pelajari bersama. Namun sebelumnya, kalian harus memahami terlebih dahulu pengertian dari elektrolit.
Pengertian Elektrolit
Elektrolit adalah suatu zat yang dapat larut dan terurai menjadi ion-ionnya. Ion-ion tersebut adalah atom-atom yang bermuatan elektrik sehingga larutannya akan menjadi konduktor elektrik yang mampu menghantarkan arus listrik.
Elektrolit umumnya adalah asam, basa, ataupun garam. Namun dapat juga berupa air atau senyawa kimia yang lainnya.
Selanjutnya kita akan mempelajari larutan elektrolit dan non elektrolit serta mempelajari cara mengetahui apakah suatu larutan dapat menghantarkan listrik atau tidak.
Pengertian Larutan Elektrolit dan Non Elektrolit
Larutan elektrolit adalah larutan yang mengandung ion-ion dari suatu zat yang larut atau terurai sehingga larutan dapat menghantarkan arus listrik.
Misalnya, larutan garam dapur (NaCl), asam sulfat (H2SO4), dan natrium hidroksida (NaOH).
Sedangkan larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Misalnya, larutan urea (CO(NH2)2) dan larutan gula (C12H22O11).
Untuk mengetahui apakah suatu larutan bersifat elektrolit atau tidak, maka dapat dilakukan pengujian dengan alat uji elektrolit yang akan mengukur kemampuan suatu larutan dalam menghantarkan arus listrik.
Alat uji elektrolit terdiri dari dua elektroda yang dirangkaian dengan lampu pijar dan dihubungkan dengan tegangan listrik.
Berikut ini adalah gambaran dari alat uji elektrolit.
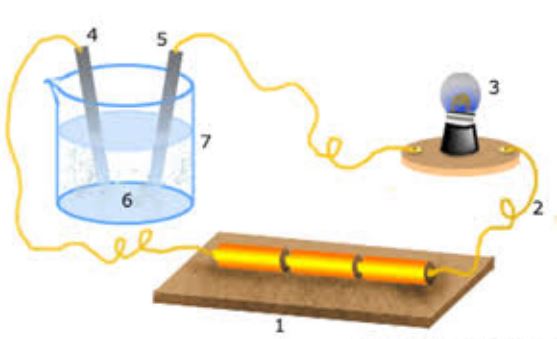
Sifat elektrolit suatu larutan dipengaruhi oleh banyaknya ion yang bergerak bebas.
Berdasarkan percobaan uji elektrolit, maka larutan elektrolit dan non elektrolit akan menunjukkan hasil yang berbeda, yaitu :
- Jika dalam percobaan suatu larutan menyebabkan lampu menyala terang dan timbul gelembung gas di sekitar elektroda, maka larutan tersebut memiliki daya hantar listrik yang baik sehingga merupakan larutan elektrolit kuat. Sedangkan jika lampu redup bahkan tidak menyala namun terdapat gelembung gas di sekitar elektroda, maka larutan tersebut memiliki daya hantar listrik yang lemah sehingga merupakan larutan elektrolit lemah.
- Jika dalam percobaan suatu larutan tidak menyebabkan lampu menyala dan di sekitar elektroda tidak terdapat gelembung gas, maka larutan tersebut tidak memiliki daya hantar listrik sehingga merupakan larutan non elektrolit.
Berikut ini adalah hasil eksperimen uji elektrolit terhadap beberapa larutan.
| No. | Larutan yang diuji | Nyala Lampu | Elektroda |
| 1 | Garam dapur (NaCl) | Menyala terang | Ada gelembung gas |
| 2 | Amonium hidroksida (NH4OH) | Tidak menyala | Ada gelembung gas |
| 3 | Larutan gula (C12H22O11) | Tidak menyala | Tidak ada gelembung gas |
Dari tabel tersebut, dapat disimpulkan bahwa garam dapur merupakan larutan elektrolit kuat, amonium hidroksida merupakan larutan elektrolit lemah, dan larutan gula merupakan larutan non elektrolit. Baca juga Titrasi Asam Basa.
Kekuatan suatu larutan elektrolit dinyatakan dengan derajat ionisasi atau derajat disosiasi yang dilambangkan dengan tanda alfa “α”.
Nilai α ini merupakan perbandingan antara jumlah mol yang terionisasi dengan jumlah mol yang dilarutkan dalam suatu larutan.
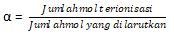
Nilai α berkisar 0 – 1 dengan ketentuan berikut.
- α = 1, artinya larutan terionisasi atau terdisosiasi sempurna sehingga merupakan elektrolit kuat
- 0 < α < 1, artinya larutan terionisasi atau terdisosiasi sebagian sehingga merupakan elektrolit lemah
- α = 0, artinya larutan tidak terionisasi atau tedisosiasi sehingga merupakan larutan non elektrolit
Nilai α dapat menjelaskan kekuatan nyala lampu dan banyaknya gelembung gas pada elektroda saat uji elektrolit. Baca juga Polimer.
Contoh Soal Larutan Elektrolit dan Non Elektrolit
1. Suatu larutan diuji dengan alat uji elektrolit dan menyebabkan lampu menyala redup dan terdapat sedikit gelembung gas di sekitar elektroda. Berdasarkan data tersebut, larutan yang diuji termasuk …
- elektrolit kuat
- elektrolit lemah
- non elektrolit
- terionisasi sempurna
- tidak terionisasi
elektrolit lemah
2. Jumlah asam asetat mula-mula adalah 10 mol dan terionisasi sebesar 2,0 mol, maka asam asetat memiliki derajat ionisasi sebesar … dan termasuk …

Karena nilai α diantara 0 – 1, maka termasuk elektrolit lemah.
3. Larutan asam sulfat dapat menghantarkan listrik dengan baik karena …
- dapat larut dalam air
- dalam air terionisasi sebelum dihubungkan dengan baterai
- merupakan senyawa ion
- mengalami ionisasi dengan adanya arus listrik
- larut dalam air dengan melepaskan elektron
Merupakan senyawa ion. Senyawa ion dalam fase larutan (pelarut air) dapat menghantarkan listrik dengan baik karena dalam larutan ion-ionnya dapat bergerak bebas.
Demikian pembahasan mengenai larutan elektrolit dan non elektrolit. Semoga bisa bermanfaat untuk kita semua. Baca juga Stoikiometri.
