Unsur-unsur di alam sangat melimpah, antara lain unsur alkali, alkali tanah, halogen, gas mulia, dan masih banyak lagi.
Dalam bab ini, unsur yang akan khusus dibahas adalah gas mulia. Tentunya gas mulia memiliki sejumlah manfaat dalam kehidupan sehari-hari karena sifat-sifat fisis dan kimia yang dimiliki.
Untuk lebih jelasnya, mari kita bahas bersama-sama.
Unsur Gas Mulia
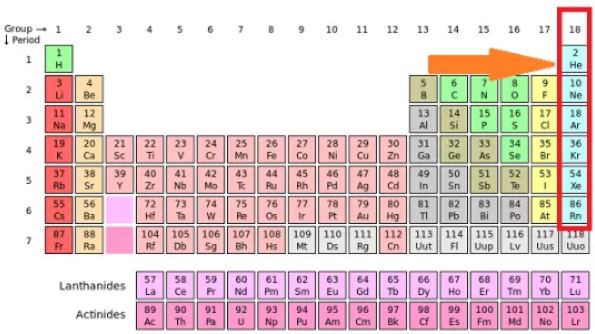
Gas mulia terletak dalam golongan VIII A (18) dalam sistem periodik. Gas mulia terdiri dari Helium (He), Ne (Neon), Ar (Argon), Kr (Kripton), Xe (Xenon), Rn (Radon).
Gas mulia adalah gas monoatomik yang mampu berdiri sendiri (ditemukan di alam dalam keadaan bebas).
Helium (He) merupakan unsur gas mulia terbanyak yang ada di alam yang terdapat di matahari.
Sedangkan unsur gas mulia lainnya terdapat dalam atmosfer dalam jumlah yang sedikit. Gas mulia dikenal sebagai unsur di alam yang berada dalam keadaan stabil.
Gas mulia dapat diperoleh melalui destilasi bertingkat udara cair, kecuali Radon yang bersifat radioaktif. Radon (Rn) diperoleh melalui reaksi inti sebagai berikut.
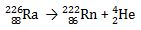
Selanjutnya kita akan mempelajari sifat-sifat fisis dan kimia dari unsur gas mulia.
Baca juga Ikatan Hidrogen.
Sifat Fisis dan Kimia Unsur Gas Mulia
| Unsur | KonfigurasiElektron Valensi | Jari-Jari Atom(Å) | Energi Ionisasi(kJ/mol) | Titik Didih(⁰C) | Titik Leleh(⁰C) |
| 2He | 1s2 | 0,50 | 2379 | -268,9 | -272,2 |
| 10Ne | 2s2 2p6 | 0,65 | 2087 | -248,0 | -248,6 |
| 18Ar | 3s2 3p6 | 0,95 | 1527 | -185,9 | -189,4 |
| 36Kr | 4s2 4p6 | 1,10 | 1357 | -153,4 | -157,2 |
| 54Xe | 5s2 5p6 | 1,30 | 1177 | -108,1 | -111,8 |
| 86Rn | 6s2 6p6 | 1,45 | 1043 | -62 | -71 |
Berdasarkan tabel di atas, ditunjukkan bahwa semakin besar nomor atom gas mulia (semakin ke bawah letaknya dalam sistem periodik), jari-jari atomnya akan semakin besar dan energi ionisasinya semakin kecil.
Gas mulia ditemukan di alam dalam keadaan bebas karena sukar bergabung dengan unsur lain yang disebabkan oleh energi ionisasinya yang besar.
Kereaktifan unsur gas mulia meningkat seiring bertambahnya nomor atom. Oleh karena itu, Xenon (Xe) merupakan unsur yang paling reaktif karena memiliki energi ionisasi yang paling kecil dan Radon (Rn) yang bersifat radioaktif.
Karena kereaktifan Xenon yang paling besar, sudah terdapat beberapa senyawa yang dapat dibuat, antara lain XePtF6, XeF2, XeF4, XeF6, XeOF4, dan Na4XeO6.
Berdasarkan sifat fisis dan kimia dari unsur gas mulia, banyak manfaat yang dapat digunakan dalam kehidupan sehari-hari.
Mari kita pelajari bersama mengenai kegunaan unsur gas mulia.
Baca juga Larutan Penyangga.
Kegunaan Unsur Gas Mulia
Berikut ini merupakan manfaat dari unsur-unsur gas mulia.
1. Helium (He)
- Untuk pengelasan logam supaya mencegah oksidasi.
- Sebagai pengisi balon udara.
- Sebagai campuran oksigen dalam tabung oksigen untuk pernapasan.
2. Neon (Ne)
- Sebagai gas pengisi pada tabung televisi.
- Sebagai pendingin (cair).
- Sebagai indikator tegangan tinggi.
- Sebagai penangkal petir.
- Sebagai pengisi lampu reklame merah.
3. Argon (Ar)
- Digunakan dalam pengelasan logam.
- Sebagai pengisi bohlam lampu listrik.
- Untuk lampu reklame dengan cahaya merah muda.
4. Kripton (Kr)
- Sebagai lampu blitz.
- Sebagai lampu pada landasan pacu bandara.
5. Xenon (Xe)
- Sebagai lampu reklame dengan cahaya biru.
- Untuk pembuatan tabung elektron.
- Sebagai pemati rasa saat proses pembedahan.
6. Radon (Rn)
- Sebagai sumber radiasi untuk pengobatan.
Contoh Soal Unsur Gas Mulia
1. Unsur gas mulia yang diperoleh dengan memancarkan sinar alfa terhadap Radium adalah …
- Helium
- Xenon
- Kripton
- Argon
- Radon
Radon
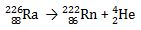
2. Xenon adalah unsur gas mulia yang paling mudah dibuat senyawa. Mengapa?
Karena Xe merupakan unsur yang paling reaktif diantara unsur gas mulia lainnya dikarenakan energi ionisasinya yang paling kecil.
Demikian pembahasan mengenai unsur gas mulia. Semoga dapat bermanfaat. Baca juga Sifat Koligatif Larutan.
